霉菌毒素是由某些生长在食品或饲料中的真菌所产生的结构类似的一大类二级代谢产物, 对生物体生理功能有很强的影响, 对人和动物的健康会造成不同程度的危害[1]。粮食和饲料在生产、收获、储存及加工过程中, 均容易受到霉菌的污染引发霉变[1, 2]。目前全球约四分之一的粮谷类食品受到不同程度的霉菌毒素污染[3], 粮谷中霉菌毒素不仅会破坏或降低其营养价值和风味, 而且会带来细胞毒性、生殖毒性、免疫毒性、遗传毒性、肝肾毒性以及致癌、致畸、致突变等毒副作用, 对人和禽畜的生长及健康均构成严重的威胁。近年来随着色谱、质谱等仪器的发展, 检出水平不断降低, 特别是传感器技术、免疫分析法、色谱质谱联用技术等新型检测技术的应用, 可以更好地对粮谷类样品中痕量的、高危害的霉菌毒素进行定性、定量分析, 有效地推动了相关法律法规的规范化, 从而减少霉菌毒素对人类的危害[4-7]。
1 霉菌毒素概述
1.1 黄曲霉毒素
黄曲霉毒素(aflatoxins, AFs)是由黄曲霉和寄生曲霉通过聚酮途径产生的有毒代谢产物[10], 其结构类似, 均含有一个双呋喃环和一个香豆素结构, 其中两个羰基氧化学性质活泼, 容易发生氢键缔合, 毒性强, 耐高温, 不耐碱[11]。花生、棉花、大豆、玉米及核桃等粮谷类食品在生产、加工、存储过程常常容易受到曲霉真菌感染[3], 携带一定量的AFs, 目前科学家已经分离鉴定出30多种AFs及其衍生物[12], 其中以黄曲霉毒素B族(AFB1、AFB2)和G族(AFG1、AFG2)在粮食谷物中较为常见[13], 黄曲霉毒素M族(AFM1、AFM2)在动物体内及其代谢物、动物源性食品中常常检出[14]。AFs具有免疫抑制、细胞毒性、生殖毒性、肝毒性和肾毒性等多种毒副作用, 最为致命的是其强致癌毒性, 国际癌症研究机构(IARC)已将毒性最强的AFB1列入人类致癌物(第1组)[10, 15, 16]。
1.2 赭曲霉毒素
1.3 玉米赤霉烯酮
玉米赤霉烯酮(zearalenone, ZEN), 又称F-2毒素, 首先从有赤霉病的玉米中分离得到, 是一种由镰刀菌毒素, 如禾谷镰刀菌、三线镰刀菌等菌株污染的玉米、燕麦、小麦等谷物中产生的代谢产物, 其具有内酯类化学结构, 性质稳定、耐热性好。自然界中, ZEN可被还原成两种非对应立体异构体:α-玉米赤霉烯醇(α-ZEL)和β-玉米赤霉烯醇(β-ZEL), 均具有雌激素活性, 其中α-ZEL的毒性为ZEN的两倍[25, 26]。该类毒素具有雌激素样活性, ZEN大量聚集可导致流产和死胎, 且婴幼儿更易受到伤害, WHO规定每日耐受量为0.5 μg/kg[27]。动物食用了该类毒素污染的饲料, 极易引起雌激素样效应且可能转移至人体, 且具有生殖毒性、肝毒性和细胞毒性, 具有潜在的致癌性[28]。ZEN污染主要存在于饲料、豆类、谷物、玉米的收割、储藏、运输过程中, 是污染原粮和饲料的最常见霉菌毒素。
1.4 脱氧雪腐镰刀菌烯醇
脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON), 又称呕吐毒素, 主要由禾谷镰刀菌(F. graminearum)和黄色镰刀菌(F. culmorum)等产生, 在小麦、大麦、燕麦、玉米等农作物中多见, 是一种分布面广、影响较大的单端孢霉烯族化合物[29]。DON对人体和动物均有较强毒性, 主要体现在影响生命体的正常生长发育, 对脾脏、心脏和肝脏等造成潜在危害[30]。DON在全球各国均有出现, 在我国主要分布于长江以南区域, 其不仅污染谷类作物及其制品, 并且会转移至肉制品、内脏及乳及乳制品、蛋等动物源食品中[31]。DON化学性质稳定, 在酸性、中性、热中稳定, 碱性条件下易分解。
1.5 伏马毒素
伏马毒素(fumonisin, FUM)是一类由串珠镰刀菌(F. moniliforme Sheld)和轮状镰刀菌(F. vertricillioides)在适宜的环境下产生的次级代谢产物, 是一类由多种多氢醇和丙三羧酸组成的双酯化合物, 耐热, 遇酸水解产物仍有部分毒性[32]。目前, 伏马毒素分离鉴别到FA1、FA2、FB1、FB2、FB3、FB4、FC1、FC2、FC3、FC4和FP1等11种, 其中60%以上是FB1, 其毒性也最强, 因而被IARC归为2B类致癌物[33]。有研究证实, 伏马毒素可产生神经毒性、肺毒性、免疫抑制、致癌性等。据报道, 我国8个省的玉米、水稻中的检出率在28%~100%之间, 最高含量达到15 252 μg/kg[34]。
近年来, 鉴于食品中的真菌毒素污染范围日益扩大, 各国和相关国际组织先后制定和修订了食品中黄曲霉毒素、赭曲霉毒素、玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇、伏马毒素等真菌毒素的限量标准。我国制定了GB 2761-2017《食品安全国家标准食品中真菌毒素限量》, 但该标准未对伏马毒素和T-2毒素制定限量。国际食品法典委员会(Codex Alimentarius Commission, CAC)则于2017年对CXS 193-1995《食品和饲料中污染物和毒素的通用标准》重新修订, 制定了食品中常见真菌毒素的最大残留限量标准。欧盟、美国、日本等地规定[35]:食品中AFB1的限量范围为0~20 μg/kg, AFs(B1+B2+G1+G2)总量的限量范围为0~15 μg/kg; OTA的限量范围为0.5~50 μg/kg, 玉米赤霉烯酮的限量范围为20~1 000 μg/kg, 脱氧雪腐镰刀菌烯醇的限量范围为200~2 000 μg/kg, 伏马毒素的限量范围为200~4 000 μg/kg。以上食品中的霉菌毒素最大残留限量法规, 以欧盟、日本规定的限量最为严格, 我国对玉米赤霉烯酮也较为严格, 其他各国对不同毒素要求各有差异。
2 霉菌毒素检测的前处理方法
霉菌毒素对粮食谷物、膳食制品的污染率高, 污染量大, 污染范围广, 且具有很强的毒副作用。制定和完善相关法律法规控制霉菌毒素引发的食品安全事故, 需要发展高效、高灵敏、通用性好的霉菌毒素分析方法。然而, 食品种类复杂多样、基质复杂, 对霉菌毒素的准确定性定量造成较大干扰; 而霉菌毒素痕量、高毒, 往往需要一定样品前处理手段将其从样品中分离、富集, 再以适当的方法进行检测。
2.1 液液萃取法
液液萃取(liquid-liquid extraction, LLE)利用待测物在两种不相溶液体或相之间分配系数的差异, 达到分离富集的目的。根据粮谷、饲料等样品基质和生物毒素化学性质特点, 常使用有机溶剂如乙腈、三氯甲烷、叔丁基甲醚或其混合溶剂从样品液中提取目标物[36]。然而, 传统的LLE法对有机溶剂需求量大, 环境保护压力大, 为此发展了基于液液萃取的新技术用于霉菌毒素的检测, 如加压液液萃取和分散液液微萃取[37, 38]。其中分散液液微萃取通过少量的萃取溶剂在分散剂的帮助下, 以小液滴的形式存在于整个体系中, 充分接触, 将目标物从体系中高效萃取, 在食品中霉菌毒素的分析中具有有机溶剂用量少、前处理操作简便等优势[39]。Zhao等[40]通过分散液液微萃取完成黄酒中多种霉菌毒素的分析, 方法检出限低于0.5 μg/kg, 样品加标回收率在84.5%~111.2%, 同时发现黄酒中霉酚酸检出较多。Wang等[41]在分散液液微萃取过程中, 耦合衍生化反应完成植物油中AFs的一步分析。但由于液液萃取步骤繁琐、选择性较差且受基质干扰影响大, 在霉菌毒素的分析中应用较少。
2.2 免疫亲和技术
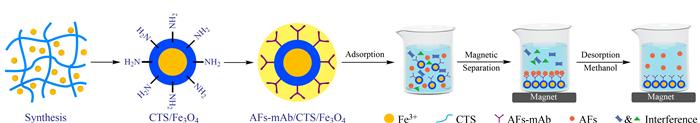
免疫亲和层析技术能通过抗原抗体结合的高度特异性在复杂样品基质中选择性捕获霉菌毒素, 再通过合适的方法使霉菌毒素解吸附, 完成样品前处理的净化和富集, 结合新型的高灵敏度仪器分析食品中痕量的霉菌毒素[42-44]。Sun等[45]采用免疫亲和层析法作为前处理手段, 结合HPLC-MS法分析食品中的AFs和玉米赤霉烯酮; 通过组合多种单克隆抗体, 制备了广谱的霉菌毒素免疫亲和层析材料, 在山药、桔梗、淫羊藿及薏仁中的加标回收率为64.7%~112.1%, 方法定量限为0.08-0.2 μg/kg。Iha等[46]通过免疫亲和层析柱分离富集花生中的AFB1、AFB2、AFG1、AFG2, 回收率为70%~125%, 满足美国分析化学家协会(Association of Official Analytical Chemists, AOAC)方法性能要求; Sun等[47]通过超广谱免疫亲和柱同时分离富集虫草中的6种AFs, 回收率为79.28%~103.42%, 方法定量限为0.008~0.045 μg/kg。Jinap等[48]直接用免疫亲和层析材料制备色谱柱, 在线完成食品中AFs的检测分析, 其中AFB1回收率为75.7%~92.9%, AFB2回收率为72.1%~103.0%, AFG1回收率为76.0%~107.9%, AFG2回收率为82.1%~103.3%。近日Xie等[49]以多重抗体为外层、壳聚糖为中层、磁性Fe3O4为核, 制备了多抗体免疫磁性纳米材料(见图 1), 用于谷物、坚果、植物油中6种AFs的分离分析; 所建立方法的富集倍数达到同类免疫亲和柱的60倍, 灵敏度有了数量级的提升。目前免疫亲和技术在食品中霉菌毒素残留分析中得到了广泛应用, 在我国多个食品安全国家标准(如GB 5009.22-2016、GB 5009.24-2016、GB 5009.96-2016)都采用此类前处理方法。但是该技术仍然具有局限性, 如单克隆抗体制备繁琐、材料修饰复杂、抗体容易失活而需控制条件、抗体价格昂贵导致免疫亲和层析柱价格不菲等。
图1
2.3 固相萃取技术
固相萃取技术通过固定吸附材料对目标组分的作用力将目标物从试样溶液中吸附, 达到分离、净化、富集的效果, 广泛应用于食品中霉菌毒素的前处理过程。孟娟等[50]通过HLB柱及石墨化炭黑(GCB)富集纯化粮食及其制品中6种玉米赤霉烯酮类物质(α-玉米赤霉醇、β-玉米赤霉醇、玉米赤霉酮、玉米赤霉烯酮、α-玉米赤霉烯醇和β-玉米赤霉烯醇), 以α-玉米赤霉烯酮-d4为内标, 6种目标物的线性范围为0.1~50 μg/L, 相关系数(R2)大于0.99, 检出限为0.1~0.2 μg/kg, 3个不同水平的平均加标回收率为79.9%~104.0%, 相对标准偏差不大于10%。Huang等[51]采用HLB复合柱作为样品富集净化手段, 分析乳制品中多种霉菌毒素, 方法具有较好的准确度(回收率87.0%~109%)和重复性(RSD 3.4%~9.9%)。传统的固相萃取材料如C18复合柱、HLB复合柱, 由于其吸附选择性差、吸附容量有限, 基质抑制效应较强, 方法灵敏度低, 限制了其在食品中痕量霉菌毒素分析中的进一步推广[52]。分子印迹聚合物技术很好地弥补了传统固相萃取材料选择性不足的缺陷[52]。Cao等[53]基于分子印迹聚合物的固相萃取材料富集净化-HPLC检测, 建立生姜中OTA的检测方法, 方法回收率为87.6%~94.5%。Liang等[54]制备了用于选择性富集黄曲霉毒素B1的分子印迹聚合物整体柱, 分析花生中黄曲霉毒素B1残留, 加标回收率为79.5%~91.2%, 日内和日间RSD分别为1.2%和4.9%, 方法检出限能达到0.118 ng/mL。
分子印迹聚合物固相萃取材料仍然有一些缺点, 如吸附容量不足、制备复杂, 但是它的出现为新型固相萃取材料的研发提供了思路。
3 霉菌毒素的检测方法
样品前处理手段尽可能将样品中的目标物组分从基体中分离, 消除干扰, 且富集到适合检测的浓度水平。而目前用于霉菌毒素的检测方法有:电化学分析法、酶联免疫分析法(enzyme-linked immunosorbent assay, ELISA)、薄层色谱法(thin layer chromatography, TLC)、气相色谱法、高效液相色谱法、高效液相色谱-质谱联用法, 其中主流技术是色谱和色谱质谱联用技术。
3.1 薄层色谱法
薄层色谱法利用真菌毒素在紫外光线产生的荧光, 并通过荧光光度强弱和斑点大小判断毒素类别和含量。TLC已被应用于AFs、OTAs、ZEN等多种霉菌毒素的检测分析[55-57]。Scott等[55]指出, 高效薄层色谱法和二维薄层色谱法能缩短分析时间并提高对霉菌毒素分析结果的准确度, 同时对硫华菊产生的微克量级的AFB1和AFG1进行了荧光衍生表征。Hoeltz等[58]用TLC联合电感耦合检测技术建立了花生中AFB1的检测方法, 定量限达到1.2 μg/kg, 方法平均回收率为98%, 在31份花生样品中检出16~115 g/kg水平的黄曲霉毒素B1。Korrapati等[59]根据AOAC方法从家畜样品中提取AFB1, 采用高效薄层色谱法分析, 在4个荧光发射波长下检测、定量, 所得到的结果与酶联免疫分析法一致。尽管如此, 由于TLC检测灵敏度受限、重复性差、不易完成自动化且准确度相对其他分析方法较差, 在食品中痕量毒素分析方面应用较少。
3.2 气相色谱法
气相色谱法利用惰性气体作载气, 通过载气将气化样品带入色谱柱中, 通过各个组分与固定相的分配系数的差异完成分离。毛细管气相色谱法具有与高效液相色谱法相当甚至更好的柱效, 其具有分离效能高、方法灵敏度高、分析速度快和选择性强等优点。早在1988年, Goto等[60]采用毛细管气相色谱法测定黄曲霉属作物产生的AFs(AFB1、AFB2、AFG1、AFG2), 其中AFB1、AFB2的检出限为1 ng, AFG1、AFG2的检出限为2 ng; 获得了较准确的分析结果, 但是受限于AFs的气化性质以及检测器的性能, 无法达到较高的检测灵敏度。Yue等[61]也采用了使用电子捕获检测器的GC法分析中药草及相关产品中的脱氧雪腐镰刀菌烯醇, 通过免疫亲和层析净化后, 加标回收率为85.5%~97.2%, RSD<6.3%, 方法检出限能达到2 μg/kg, 定量结果与气相色谱-质谱联用技术一致。由于霉菌毒素并不都具有良好的气化性能, 限制了GC法的检出限以及适用性, 故近年来较少采用GC法或GC-MS法分析霉菌毒素。
3.3 电化学分析法
电化学分析法是建立在物质在溶液中电化学性质基础上的一种分析方法, 能基于物质的电化学性质及变化规律对试样中组分完成定性定量分析, 其灵敏度高、准确度好, 近年来有不少新型的电化学分析技术研发并应用于霉菌毒素的检测分析。Jalalvand[62]利用石墨烯、多壁纳米管以及金纳米颗粒对玻碳电极逐步修改, 制备了一种新型、高效的电流传感器, 能准确、超灵敏地检测葡萄汁中中含量在0.01~10 nmol/L之间的OTA, 检出限达5×10-11mol/L。为弥补电化学传感器选择性不强的弱项, 分子印迹聚合物技术被引入至电化学传感器, Wang等[63]基于联吡啶钌(Ru(bpy)32+)掺杂的二氧化硅纳米粒子结合分子印迹聚合物研发了电化学发光传感器, 应用于玉米中OTA的检测, 当OTA含量为0.1~14.76 ng/mL, 方法检出限能达0.027 pg/mL。Pacheco等[64]基于多壁碳纳米管和分子印迹聚合物修饰玻碳电极所研发的电化学传感器对啤酒和白酒中的OTA具有较好的选择性和检测灵敏度, 当加标水平为0.050和1.0 μmol/L时, 其检出限和定量限分别为1.7和5.7 μg/L, 对应的RSD分别为4.2%和7.5%。除了采用分子印记聚合物技术弥补电化学传感器的选择性不足外, 还可采用生物分子作相关修饰。Mo等[65]通过共价键键合将核酸适配体固定在多孔阳极氧化铝纳米通道的表面上, 进一步修饰氧化石墨烯, 制备核酸适配体功能化的电化学传感器, 其对AFB1的检出限为0.13 ng/mL。Xia等[66]研发了一款基于Hep G2细胞的电化学生物传感器, 用以评估脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮及AFB1对Hep G2细胞的抑制效果, 结果表明:当脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮及AFB1的质量浓度分别为0.01~20、0.1~50及0.1~3.5 μg/mL时, Hep G2细胞的半抑制浓度(IC50)分别为48.5、59.0及3.10 μg/mL。此外, Xiao等[67]研发了基于核酸适配体修饰的毛细管电泳技术, 检测食品中痕量的OTA和AFB1, 检测时长为3 min以内, 检出限很低:OTA为0.021 ng/mL, AFB1为0.026 ng/mL。电化学分析法操作简便、分析时间短、结果准确度高、具备高检测灵敏度, 但是仍受限于重复性差, 不能得到很好的推广。
3.4 免疫分析法
免疫分析法基于抗原抗体的高度特异性结合, 选择性强、灵敏度高, 可分为非标记和标记免疫分析技术。在食品中真菌毒素检测中常用的标记免疫分析技术是ELISA:让抗体与酶复合物结合, 然后通过显色来检测; 特异性好、灵敏度高、操作简单[68], 已经在我国食品安全国家标准(GB 5009.22-2016、GB 5009.24-2016、GB 5009.96-2016)中应用于食品中AFs和OTA的检测。Oplatowska等[69]以7种单克隆抗体建立了食品中AFs的酶联免疫分析法, 方法的检测限为0.4 μg/kg, 应用于花生中AFB1的检测, 定量检测结果与液相色谱-质谱联用技术的结果具有良好的一致性。Tsounidi等[70]和Eivazzadeh-Keihan等[71]分别利用免疫分析法的高度特异性, 研发了基于免疫传感器的毒素快速分析方法。Nabok等[72]以偏振衍射仪为基础研发了一种平面波传导为检测原理的免疫传感器, AFB1的检出限可达0.01 ng/mL。Xie等[73]以多孔纳米片作为荧光探针, 设计了一种基于磁性纳米颗粒的AFB1免疫传感器, AFB1的检出限可达0.002 ng/mL。而Bacher等[74]所研发的银线阻抗免疫传感器能检测到牛奶中1 pg/mL的AFM1。免疫分析法由于特异性强、灵敏度好、分析速度快、操作简单等优点, 在霉菌毒素的快速检测领域具有很好的发展前景[75], 但是它不易实现自动化, 且免疫抗体合成及修饰复杂、价格昂贵, 可能会限制它在霉菌毒素分析检测领域的发展。
3.5 高效液相色谱法
高效液相色谱法在食品中霉菌毒素残留分析中也有广泛的应用。张晓旭等[76]采用柱后衍生-高效液相色谱法测定玉米中的伏马菌素B1和B2, 检出限均为0.02 mg/kg, 在0.1~4.0 mg/kg范围内, 3个添加水平的平均回收率为82.5%~89.8%。Al-Hazmi等[77]通过HPLC法测定沙特阿拉伯市售果汁中的展青霉素和OTA, 并检出1例果汁中展青霉素超标和5例OTA超标。由于AFs的紫外吸收信号小, 检测灵敏度低, 往往需要一些衍生化技术, 采用荧光分析法灵敏、准确分析试样中AFs的含量, 检测灵敏度能与色谱-质谱联用技术相媲美[78]。于彦彬等[79]在固相萃取净化后, 采用高效液相色谱柱后衍生荧光检测花生中黄曲霉毒素(B1、B2、G1和G2), 回收率为68.8%~101%, RSD为5.0%~7.1%, Hepsag等[80]通过HPLC柱后衍生法建立了开心果和花生中AFs的分析方法, 4种AFs的定量限为0.11~0.14 μg/kg。Golge等[81]也采用柱后衍生化HPLC分析核桃中的AFs, 定量限为0.106~0.374 μg/kg, 在112份实际样品中检出43.8%的样品含有AFS。也有通过柱前衍生化HPLC法分析AFs的实例:苏静华等[82]利用柱前光衍生化HPLC建立胖大海中AFs的检测方法, 检测灵敏度高, 回收率为97.06%~99.93%。柱前衍生化技术相对柱后衍生化更加方便、准确, 与GB 5009.22-2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》技术路线一致。另外Geng等[83]在检测器流通池方面, 开发了流通池集成紫外诱导荧光检测器检测AFs。
3.6 色谱-质谱联用技术
色谱-质谱联用技术兼具色谱法的高效分离和质谱检测器的通用性, 对霉菌毒素检测的适用性广、灵敏度高, 能完成食品或饲料中多种霉菌毒素的同时检测[84-87]。Meerpoel等[88]采用UPLC-MS法建立了能同时分析食品和饲料中OTA和桔霉素的检测方法, 定量限分别为5.6和3.9 μg/kg, 方法性能指标满足欧盟No. 401/2006/EC和No. 2002/657/EC指令要求。Stefanovic等[89]对比了ELISA和超高效液相色谱-质谱(UPLC-MS)两种检测方法对牛奶中AFM1及玉米中AFB1的分析, 两种方法都具有特异性高和灵敏度高的特性, 适用性和可靠性得到了很好的验证。在生物化学和体内毒理分析中, UPLC-MS/MS对霉菌毒素的分析也得到了广泛的应用。González-Arias等[90]采用UPLC-MS法分析共培养系统中霉菌产生的OTA, 发现未来可采用OTA甲酯作为OTA暴露水平的生物标志物进行研究。Han等[91]通过UPLC-MS研究了大鼠体内OTA的体内动力学和生物转化, 在大鼠肾脏和脾脏中鉴定了OTA的代谢产物OTβ(ochratoxin β)和OTB(ochratoxin B)甲酯, 证实了OTA的一种代谢途径。近年来, 为了简化前处理步骤、缩短分析时间, 实时直接分析(direct analysis in real time, DART)与UPLC-MS联用应用于食品中霉菌毒素的分析检测:宫小明等[92]采用利用QuEChERS技术对红酒样品进行前处理, 直接进样分析, 无需色谱分离, 既节省了分析时间, 又减少了有机溶剂的使用, 适合大批量酒样中OTA污染残留检测。
3.7 质谱成像技术
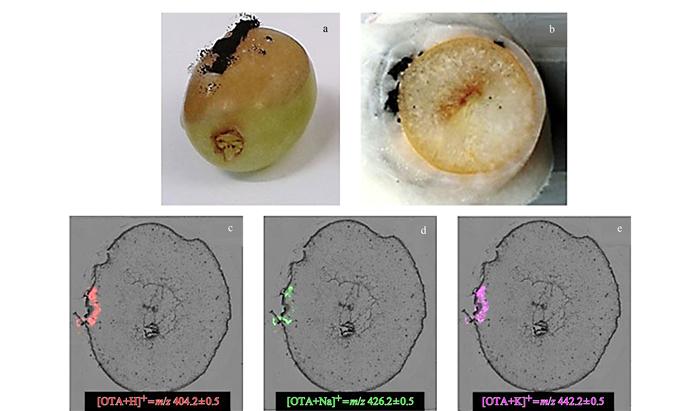
质谱成像技术(mass spectrometry imaging, MSI)将质谱离子扫描技术与成像技术结合, 可视化呈现组织切片中目标物的质荷比(m/z)信息, 再通过软件进行有效数据的提取、分析和归类[93]。Hickert等[94]以基质辅助激光解吸-飞行时间质谱成像技术可同时鉴别被真菌毒素污染的葡萄中OTA及12种伏马毒素(见图 2), 可直观显示样品被污染的程度及污染区域。De Oliveira等[95]通过花生皮和花生仁切片、制样后, 以SPI(silica plate imprinting)-MSI鉴别污染的黄曲霉毒素(B1、B2、G1和G2)的空间分布, 可实时、快速鉴定坚果中真菌污染的空间分布。Berisha等[96]采用激光解吸-高分辨质谱成像技术, 在无任何样品前处理情况下, 对小麦种子中的DON毒素进行快速筛查鉴定, 质量数误差小于2 ppm(2×10-6), 且方法分辨率不受样品基质中水分含量的影响。MSI检测真菌毒素的优势在于, 简化(或无需)样品前处理过程、可快速鉴别多种类毒素, 且同时确定毒素样品中的污染分布。然而MSI技术属于典型的定性分析技术, 尽管鉴别筛查效率很高, 但是对于初筛出的阳性样品, 后续仍需LC-MS/MS技术进一步确证。因此, MSI在食品安全检测中的应用尚不广泛。
图2
4 小结
目前, 对于食品中霉菌毒素的分析检测, 已经发展了基于液液萃取、固相萃取、磁性材料萃取和核酸适配体材料的样品前处理技术, 以及基于免疫分析、传感器技术和快速色谱-质谱检测技术的联用, 以满足检出限不断提高的毒素检测需求。但其样品前处理步骤仍然较为繁琐, 高灵敏的定性定量检测仍依赖于色谱及色谱-质谱联用等大型仪器设备, 价格昂贵, 普及面受限。在提高分析效率、降低成本、减少前处理步骤方面主要有以下发展趋势。(1)研发新型高选择性填料, 例如磁性材料、功能化材料等; 引入荧光标记技术、电化学发光、纳米量子点、微流控芯片技术, 提高毒素检测前处理技术精准度和操作的便利性, 但新型材料的价格仍然是需要解决的难题。(2)质谱及联用技术的应用日趋广泛, 降低了毒素检测成本, 缩短了分析时间, 同时满足了政府监管部门对于毒素高通量的检测需求, 提高了监管效能, 进一步提升了食品安全的保障能力, 促进了贸易便利化。综上所述, 食品中霉菌毒素检测技术受到国内外研究者和相关监管部门的高度关注, 技术发展很快, 法律、标准也在不断完善, 未来将对维护食品安全和消费者健康起到重要作用。
参考文献